Blog
Döteryum Nedir? Nerelerde Kullanılır?

Döteryum nedir? İşte döteryumun ne olduğuna, onu nerede bulabileceğinize ve döteryumun bazı kullanımlarına bir göz atın.
Döteryum Tanımı
Hidrojen, adı verilen üç izotopa sahip olması bakımından benzersizdir. Döteryum, hidrojenin izotoplarından biridir. Bir proton ve bir nötrona sahiptir. Buna karşılık, hidrojen izotopu olan protyum’un en yaygın izotopu bir protona sahiptir ve nötronu yoktur . Döteryum bir nötron içerdiğinden, protyumdan daha masif veya daha ağırdır, bu nedenle bazen ağır hidrojen olarak adlandırılır . Her atom bir proton ve iki nötron içerdiği için ağır hidrojen olarak da adlandırılabilen üçüncü bir hidrojen izotopu, trityum vardır.
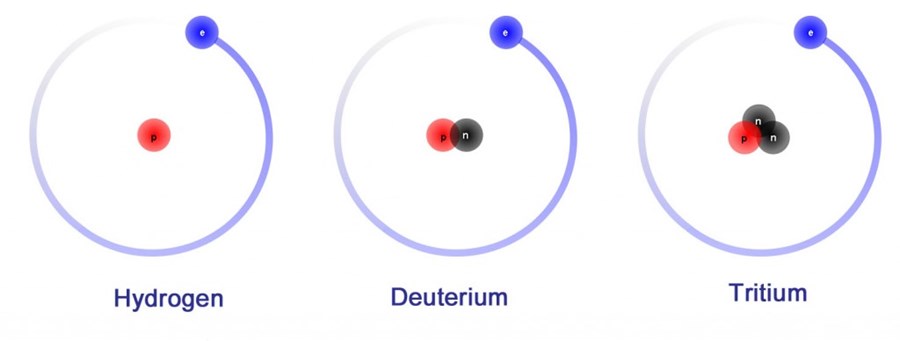
Döteryum Gerçekleri
- Döteryumun kimyasal sembolü D’dir. Bazen 2 H sembolü kullanılır.
- Döteryum, kararlı bir hidrojen izotopudur. Başka bir deyişle döteryum radyoaktif değildir .
- Doğal miktarında okyanusta döteryum yaklaşık hidrojen 6.400 bir atomu 156.25 ppm vardır. Başka bir deyişle, okyanustaki hidrojenin %99.98’i protyumdur ve sadece% 0.0156 döteryumdur (veya kütlece %0.0312).
- Döteryumun doğal bolluğu bir su kaynağından diğerine biraz farklıdır.
- Döteryum gazı, doğal olarak oluşan saf hidrojenin bir şeklidir. Kimyasal formülü 2H2 veya D2 olarak yazılır . Saf döteryum gazı nadirdir.
- Döteryumun adı, Yunanca “ikinci” anlamına gelen deuteros kelimesinden gelir. Bu referans olarak, döteryum atomunun çekirdeğini oluşturan iki parçacık, bir proton ve bir nötrondur.
- Döteryum çekirdeğine döteron veya deuton denir.
- Nükleer füzyon reaktörlerinde izleyici olarak ve ağır su moderatörlü fizyon reaktörlerinde de nötronları yavaşlatmak için kullanılır.
- Döteryum, 1931’de Harold Urey tarafından keşfedildi. Ağır su örnekleri üretmek için yeni hidrojeni kullandı. Urey, 1934’te Nobel Ödülü’nü kazandı.
- Döteryum, biyokimyasal reaksiyonlarda normal hidrojenden farklı davranır. Örneğin, az miktarda ağır su içmek ölümcül olmasa da , büyük miktarda su içmek ölümcül olabilir.
- Döteryum ve trityum, hidrojenin protium izotopundan daha güçlü kimyasal bağlar oluşturur. Farmakolojinin ilgisini çeken, karbonu döteryumdan uzaklaştırmak daha zordur. Ağır su, sıradan sudan daha viskozdur ve 10,6 kat daha yoğundur.
- Döteryum, hem tek sayıda proton hem de nötron içeren beş kararlı çekirdekten biridir. Çoğu atomda, tek sayıda proton ve nötron, beta bozunması açısından kararsızdır.
- Döteryumun varlığı, güneş sistemindeki diğer gezegenlerde ve yıldızların spektrumlarında doğrulandı. Dış gezegenler kabaca birbirleriyle aynı döteryum konsantrasyonuna sahiptir. Bugün mevcut döteryumun çoğunun Big Bang nükleosentez olayı sırasında üretildiğine inanılıyor. Güneşte ve diğer yıldızlarda çok az döteryum görülür. Döteryum yıldızlarda proton-proton reaksiyonuyla üretilenden daha hızlı tüketilir.
- Doğal olarak oluşan ağır suyu büyük hacimli doğal sudan ayırarak yapılır. Döteryum bir nükleer reaktörde üretilebilir, ancak yöntem uygun maliyetli değildir.
