Blog
Su Sertliği

Su sertliği suda bulunan iki değerlikli metal katyonlarının sebep olduğu, sabunun köpürmesini güçleştiren, kazan taşı oluşumuna yol açan, bazı
endüstriyel işlemlere zarar veren, suyun tadını bozan ve bu şekilde su kalitesini etkileyen bir parametredir. Sertlik oluşturan katyonlar kalsiyum, magnezyum, stronsiyum, demir ve mangan iyonlandır. Bu iyonların tuzlarını çözünmüş olarak bulunduran sular “sert sular” olarak adlandırılmaktadır.
Ancak Ca ve Mg dışındaki katyonlar doğal sularda çok az bulunduklarından sertliğe fazla katkıları bulunmamaktadır. Bu yüzden toplam sertlik Ca ve Mg iyonu konsantrasyonlarının toplamı olarak tanımlanmakta ve mg CaC03 1 L olarak ifade edilmektedir.
Sulardaki sertlik iki türlüdür, bunlar; bikarbonatların oluşturduğu ve kaynatılmakla giderilen “geçici sertlik” ve Ca ve Mg iyonlarının bikarbonat dışında sülfat gibi diğer anyonlar ile oluşturdukları tuzlarının yol açtığı ve kaynatılmakla giderilemeyen “kalıcı sertlik” tir.
Suyun sertliğini gidermek için en pratik yöntem toz halinde kireç (Ca(OH)2) ve soda (Na2C03) kullanımıdır. İyon değiştirici reçineler kullanılarak da sular yumuşatılabilmektedir. İyon değiştirmede sert suda istenmeyen Ca, Mg, Fe gibi iyonlar Na iyonları ile değiştirilebilir. Sert su iyon değiştirici bir kolon ya da tabakadan geçirildiğinde iyon değişimi meydana gelir. İyon değişticiciler ya zeolit denen doğal ya da yapay reçine türü bir madde olabilir.
Bu şekilde su kullanım amacına uygun hale getirilebilir. Ancak yumuşak sular proseste, yemek pişiminde, çamaşır yıkamada uygun olmakla beraber, içme sularında düşük kalsiyum, magnezyum ve yüksek sodyum içeren suların bazı sağlık sorunlarına yol açtığı unutulmamalıdır.
Su Sertliğinin Oluşumu
Sertlik su içinde çözünmüş ( +2) değerlikli iyonların sonucudur.
Suda bulunan
- HC03-, S04-2, cr, N03-,Si03-
anyonlarının bu katyonlarla oluşturdukları tuzlar sulardaki sertliği oluştururlar. ( + 2) değerlikten daha yüksek değerlik taşıyan Fe+3 ve Al+3 gibi katyonlarda bazen sertliğe neden olabilir ancak bunlar yüzeysel suların sahip olduğu pH 7 civarında çok düşük çözünürlük çarpımına sahiptirler ve kolayca çökerler.
Sulardaki sertlik suyun toprak ve kaya oluşumları ile teması sonucu meydana gelir.
Yağmur suları çözünmüş halde atmosfer gazlarını içerebileceğinden pH’sı düşebilir. Yere düştüğünde de toprak ve kayalardaki bazı bileşenleri çözer. Fakat pH’sı 7 civarında olan yağmur suyu doğal sularda çok miktarda bulunan sertlik kaynağı maddelerin hepsini çözüp taşımaya yeterli değildir.
Bu şekilde yağmur suyu toprağa indiğinde sertlik oluşturan tüm maddeleri çözemez. Bu iyonların toprağa geçmesi için asidik koşulları topraktaki bakteri faaliyetleri sonucu oluşan C02 gazının suda çözülmesi sağlar.
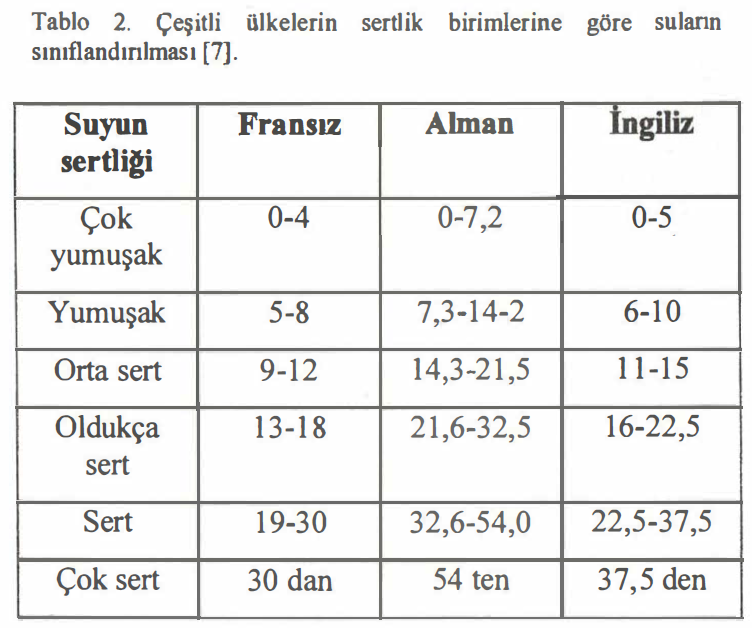
Sertlik Dereceleri
Suların sertliği 100 mL (veya 1 L) suda kalsiyum oksit veya karbonatlarının miktarı ölçü alınarak sertlik derecesi (SD) birimi ile ifade edilir. Suların mg CaC03 1 L olarak sertlik sınıflandırılması Tablo 1. de gösterilmiştir.
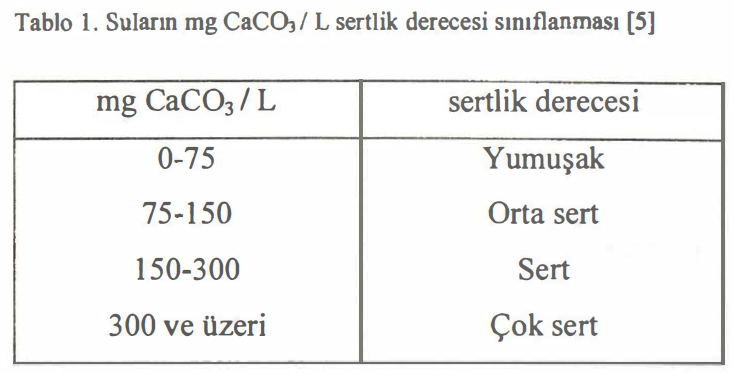
Çeşitli ülkeler farklı sertlik dereceleri kullanmaktadır.
Bunlar arasında en yaygın kullanılan ve karşılığı olan kalsiyum oksit ve kalsiyum karbonat miktarları şu şekildedir listelenebilir:
- Fransız S.D.: 100 mL suda 1 mg CaC03
- Alman S.D. : 100 mL suda ı mg CaO
- İngiliz S.D.: 700 mL suda 10 mg CaC03
- USA S.D.: ıoo mL suda 0,1 mg CaC03
Ülkemizde Fransız Sertlik Derecesi kullanılmaktadır.